Озон
| Озон | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
Трикислород |
| Традиционные названия | Озон |
| Хим. формула | O3 |
| Физические свойства | |
| Состояние | голубой газ |
| Молярная масса | 47,998 г/моль |
| Плотность |
0,0021445 г/см³ (газ при 0 °C); 1,59(7) г/см³ (жидкость при 85,2 К); 1,73(2) г/см³ (твёрдый вид при 77,4 К)[1] |
| Поверхностное натяжение |
43,8 Н/м (77,4 К); 38,4 Н/м (90,2 К)[1] Н/м |
| Динамическая вязкость |
4,17 мПа·с (77,6 К); 1,56(2) мПа·с (90,2 К)[1] |
| Термические свойства | |
| Температура | |
| • плавления | −197,2 °C |
| • кипения | −111,9 °C |
| Критическая точка | |
| • температура | −12,0 °С (261,1 К)[1] °C |
| • давление | 54,6 атм.[1] |
| Мол. теплоёмк. | 85,354 − 0,2812·(T − 90) (ж., при T от 90 до 160 К)[1] Дж/(моль·К) |
| Энтальпия | |
| • образования | 144,457 (при 0 К, отн. О2)[1] кДж/моль |
| Коэфф. тепл. расширения |
2,0·10−3 К−1 (жидкость, 90,1 К) 2,5·10−3 К−1 (жидкость, 161 К)[1] |
| Химические свойства | |
| Растворимость | |
| • в воде | 1,06 г/л (при 0 °С)[2] |
| Диэлектрическая проницаемость | 1,0019 (г), 4,79 (ж)[1] |
| Оптические свойства | |
| Показатель преломления |
1,0533 (газ, 480 нм) 1,0520 (газ, 546 нм) 1,0502 (газ, 671 нм) 1,2236 (жидкость, 535 нм) 1,2226 (жидкость, 589 нм) 1,2213 (жидкость, 670,5 нм)[1] |
| Структура | |
| Дипольный момент | 0,5337 Д |
| Безопасность | |
| ЛД50 | 4,8 ppm |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Озо́н — это светло-голубой газ, обладающий раздражающими свойствами и потенциально взрывоопасный и токсичный даже в низких концентрациях. В естественных условиях он присутствует на небольших уровнях в стратосфере, где защищает жизнь на Земле, поглощая ультрафиолетовые лучи солнца, которые могут причинить серьёзный вред. В определённых атмосферных условиях фотохимические реакции между оксидами азота и углеводородами могут приводить к образованию озона в концентрациях, способных вызывать раздражение глаз и слизистых оболочек[3].
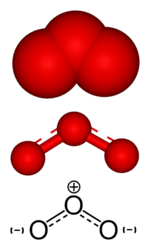
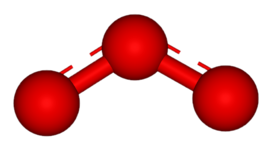
Строение озона
Обе связи O—O в молекуле озона имеют одинаковую длину, составляющую 1,278 Å. Угол между этими связями равен 116,8°. Центральный атом кислорода sp²-гибридизирован и имеет одну неподелённую пару электронов. Порядок каждой связи равен 1,5, а резонансные структуры представляют собой локализованную одинарную связь с одним атомом и двойную — с другим, и наоборот. Молекула озона полярна, а её электрический дипольный момент составляет 0,5337 Д[4].
История открытия
Озон был открыт в 1785 году нидерландским учёным Мартином Ван Марумом. Во время своих экспериментов он пропустил электрический ток через воздух и заметил необычный запах, что привело к образованию синеватого газа. Этот газ оказался более окислительным, чем кислород, и влиял на ртуть, лишая её блеска и заставляя прилипать к стеклу. Ван Марум не считал своё открытие значительным, однако через полвека немецкий учёный Кристиан Фридрих Шёнбейн снова заинтересовался озоном. В 1840 году он назвал это вещество «озоном», что на греческом означает «пахнуть», из-за его характерного запаха. Ошибочно многие считают Шёнбейна первооткрывателем. Он провёл эксперимент, в котором озон вытеснял йод из йодида калия, что позволило определить его наличие с помощью йодкрахмальной бумаги, которая принимает синий цвет.
В 1880 году французские учёные Готфейль и Шаппюи получили озон из кислорода при температуре −23 °C. Постепенно сжимая газ, они заметили, что он приобретал тёмно-синий цвет. Затем, резким снижением давления и дальнейшим понижением температуры, удалось получить фиолетовые капли жидкого озона. Если вещество не подвергать охлаждению или сжимать слишком быстро, оно мгновенно превращалось в кислород с жёлтой вспышкой[3].
Физические свойства
Молекулярная масса озона составляет 48 а. е. м. При нормальных условиях плотность газа равна 2,1445 г/дм³. Относительная плотность по сравнению с кислородом — 1,5, а по отношению к воздуху — 1,62 (1,658). Плотность жидкости при −188 °C (85,2 К) равняется 1,59(7) г/см³. Плотность твёрдого озона при −195,7 °C (77,4 К) составит 1,73(2) г/см³.
Температура кипения озона — −111,8(3) °C (161,3 К), а жидкий озон имеет тёмно-фиолетовый цвет. Температура плавления равна −197,2(2) °C (75,9 К). Указанная иногда температура плавления −251,4 °C (21,7 К) является ошибочной из-за игнорирования высокой способности озона к переохлаждению. Некоторые источники указывают температуру плавления −192,5(4) °C (80,6 К). В твёрдом состоянии озон имеет чёрный цвет с фиолетовым отливом.
Критическая температура озона составляет −12,0 °C (261,1 К), а критическое давление — 51,6 атм. Коэффициент диффузии (при 300 К и 1 атм) равен 0,157 см²/с. Теплота плавления составляет 2,1 кДж/моль. Теплота испарения при температуре кипения варьируется от 11,17 до 15,19 кДж/моль; при 90 К — от 15,27 до 16,6 кДж/моль.
Растворимость озона в воде при 0 °C составляет 0,394 кг/м³ (0,494 л/кг), что в 10 раз больше, чем у кислорода. Эта растворимость сильно зависит от чистоты воды, так как примеси могут вызывать распад озона. Жидкий озон хорошо смешивается с жидкими аргоном, азотом, фтор, метаном и углекислотой, а также с жидким кислородом при температурах выше 93 К — при более низких температурах наблюдается расслоение на две фазы. Он также хорошо растворяется в фреонах, образуя стабильные растворы, которые используются для хранения и транспортировки.
Потенциал ионизации молекулы составляет 12,52 эВ. В газообразном состоянии озон является диамагнитным, а в жидком — слабопарамагнитным. Запах озона резкий, специфический, «металлический» (по Менделееву — «запах раков»), а в высоких концентрациях напоминает запах хлора. Запах ощущается даже при разбавлении в 1:100 000[5].
Химические свойства
Озон — это мощный окислитель (сильнее кислорода, но слабее фтора), который образует высоко-реакционноспособный атомарный кислород в реакции (ат.)
Он окисляет все металлы, за исключением Au и Pt, а также большинство неметаллов. После некоторого окисления на поверхности хорошо противостоят воздействию озона такие металлы, как , а также безуглеродные сплавы железа с 25 % хрома.
В реакциях с озоном часто выделяется кислород.
- Озон взаимодействует с неметаллами, окисляя их до высших оксидов:
- Взаимодействие с металлами:
- Озон взаимодействует с оксидами, переводя низшие в высшие:
, кислород окисляет только до :
- Озон взаимодействует с сульфидами, селенидами и теллуридами, переводя их в сульфаты, селенаты и теллураты:
, происходит обесцвечивание.
- Качественная реакция на озон — йодокрахмальная реакция:
Бумага, смоченная в растворе и крахмала, синеет в присутствии озона.
Каучук и резина под воздействием озона быстро разрушаются, а многие горючие органические вещества (например, спирты, кетоны и углеводороды) могут воспламеняться или взрываться при контакте с озоном[6].
Получение озона
Поскольку молекула озона нестабильна, она должна использоваться сразу же после получения. Для производства озона применяются специальные устройства — генераторы озона, или озонаторы. В настоящее время существует три основных способа получения озона в промышленности:
- УФ-облучение.
- Электролиз.
- Электросинтез с использованием коронного разряда.
Получение озона с использованием УФ-облучения
Воздух, содержащий кислород или очищенный кислород, пропускается через специальную камеру, где коротковолновое УФ-облучение вызывает диссоциацию молекул кислорода на два атома, после чего образуется озон путём соединения одного атома с молекулой кислорода. Этот метод часто используется в кабинетах физиотерапии, где запах озона сопровождает процедуры кварцевания. Однако метод применяется довольно ограниченно, так как концентрация получаемого озона не превышает 0,1 % по весу, что недостаточно для эффективной очистки и обеззараживания воды в промышленных условиях[7].
Электролитический способ производства озона
Этот метод основывается на электрохимических реакциях: при пропускании электрического тока через растворы электролитов в специальных ячейках происходит разложение молекул воды, в результате чего образуется атомарный кислород, а затем озон.
С помощью этого способа можно обрабатывать воду большими дозами озона и достигать высоких концентраций благодаря отсутствию потерь, связанных с передачей озона из газовой фазы в раствор. Эти потери характерны для технологий, использующих УФ-облучение или электросинтез. Тем не менее, значительные энергозатраты не позволили электролитическому методу широко распространиться в промышленности.
Электросинтез озона в коронном разряде
Этот способ получения озона считается самым надёжным и эффективным, поэтому он получил наибольшее применение в промышленности. Он отличается оптимальным соотношением энергозатрат и концентрации получаемого озона.
Коронный разряд, представляющий собой слабое голубовато-фиолетовое свечение, возникает в газе в сильно неоднородном электрическом поле между двумя электродами — высоковольтным и заземлённым, разделёнными зазором (разрядным промежутком) и диэлектриком. Озон формируется в результате диссоциации молекулы кислорода под воздействием энергии электронов, движущихся между электродами через разрядный промежуток. Концентрация озона зависит от величины напряжения, его частоты, толщины диэлектрика, величины диэлектрической постоянной, а также от концентрации кислорода в рабочем газе, что определяется типом используемого газа: осушенным или неосушенным воздухом, кислородом и давлением в разрядном промежутке[7].
Токсичность
В умеренных концентрациях озон не является токсичным. Однако его высокая окисляющая способность и образование свободных радикалов кислорода в ряде реакций делают его токсичным при повышенных концентрациях. Чрезмерное воздействие озона на организм может привести к преждевременной смерти.
Наиболее опасным является воздействие высоких концентраций озона в воздухе, особенно для органов дыхания, так как он может вызывать прямое раздражение. Озон в Российской Федерации отнесён к первому, самому высокому классу опасности для здоровья. Установлены следующие нормативы по озону:
- Максимальная разовая предельно допустимая концентрация (ПДК м.р.) в атмосферном воздухе населённых пунктов составляет 0,16 мг/м³.
- Среднесуточная предельно допустимая концентрация (ПДК с.с.) в атмосферном воздухе населённых мест — 0,03 мг/м³.
- Предельно допустимая концентрация (ПДК) в воздухе рабочей зоны равна 0,1 мг/м³.
- Минимальная смертельная концентрация (LC50) составляет 4,8 ppm.
- Порог человеческого обоняния приближённо равен 0,01 мг/м³.
Озон эффективно уничтожает плесень, бактерии и вирусы[8].
Примечания
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 1,9 Лунин, 1998.
- ↑ Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. ss. 91—100. Auflage. de Gruyter, 1985, S. 460.
- ↑ 3,0 3,1 Химический элемент озон - формула, строение и основные свойства газа Источник: https://nauka.club/khimiya/ozon.html. nauka.club (29 августа 2019). Дата обращения: 6 сентября 2024.
- ↑ Озон. hemi.nsu.ru. Дата обращения: 6 сентября 2024.
- ↑ Химические, физические и тепловые свойства озона O3. Растворимость озона.. dpva.ru. Дата обращения: 6 сентября 2024.
- ↑ Химические свойства озона. studfile.net. Дата обращения: 6 сентября 2024.
- ↑ 7,0 7,1 Получение озона. триотехника.рф. Дата обращения: 6 сентября 2024.
- ↑ Ядовитый озон. ecoteco.ru. Дата обращения: 6 сентября 2024.
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |











