Металлы
Мета́ллы — класс неорганических веществ, которые являются одними из самых значимых и распространенных материалов в жизни человека. Они играют ключевую роль в множестве экономических отраслей.[1]
Введение
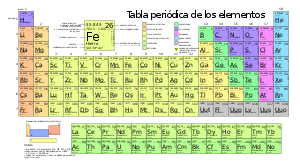
Металлы обладают такими свойствами, как прочность, эластичность, тепло, электропроводность, металлический блеск. Это делает их одними из главных компонентов в производстве различных изделий. Первые известные нам предметы из металла были созданы еще в древности. С появлением кузнечного дела человечество получило возможность использовать металлы для создания оружия, инструментов и предметов повседневного пользования [2]. С течением времени процесс обработки металлов становился все более совершенным, позволяя создавать более сложные конструкции и изделия [3]. Сегодня мы не можем представить мир без использования металлов. Будь то автомобильные детали, компьютерные чипы или хирургические инструменты - все они содержат в себе различные виды металлов [4]. Каждый металл имеет отличную от других структуру и свойства, это позволяет людям адаптировать его под разнообразные потребности. Без них практически невозможно представить развитие нашей цивилизации. В настоящее время известно 118 химических элемента, 98 из которых — металлы[5].
Историческая справка
Начало открытия металлов
Металлы были известны человеку с древних времен, но они нашли применение только тогда, когда их научились обрабатывать. В истории развития металлов человечеством выделяют каменный, медный, бронзовый и железный века[6].
1) Медный век.
Первым металлом, который стали использовать для изготовления орудий труда и оружия стала медь. При смешивании черного порошка оксида меди (II) с углем и их нагревании образуется медь[6]. Именно так древние люди на костре могли получить медь из медной руды.
2) Бронзовый век.
Бронза – это сплав меди с оловом. Бронза тверже и прочнее меди.
3) Железный век.
С середины первого тысячелетия до н.э. человечество научилось добывать железо из руды[7].
Использование человеком металлов можно считать условием, определившим развитие цивилизации. Золото и серебро также с давних времён использовались человеком: эти металлы использовали для процесса обмена.
Открытие отдельных элементов
Литий
Литий был открыт в 1817 году шведским химиком Августом Арфведсоном, при изучении минерала петалита, найденном на железном руднике Уто в Швеции. Точно установив, что содержания кремния, алюминия и кислорода в минерале составляют 96% массы минерала, учёный предположил, что оставшиеся 4% принадлежат неизвестному щелочному металлу. В чистом виде новый элемент впервые выделил британский химик и геолог Гемфри Дэви в 1818 году. Позже, по предложению Берцелиуса, новый металл получил название литий, так как был найден в камнях, от др. греч. «λίθος» — камень. В большинстве европейских языков, как и в латыни, элемент №3 называется «lithium» и обозначается символом Li[8].
Калий
В 1807 году английский химик и физик сэр Г. Дэви впервые выделил в чистом виде калий. Он утверждал, что, если когда-нибудь будут найдены залежи калийных солей, то из них можно будет получать прекрасные удобрения. Первые крупные месторождения калия были открыты в Саксонии, а добыча его началась в 1857 году. Первую фабрику по переработке природных солей ввели в эксплуатацию в 1861 году. В дальнейшем богатые залежи были обнаружены в Ганновере, Эльзасе, Гарде[9].
Барий
В 1602 году болонский сапожник и алхимик Касциароло нашел в горах близ Болоньи камень, который был до того тяжёл, что Касциароло предположил, что в нем находится золото. В попытках выделить золото из камня, алхимик прокалил его вместе с углём и олифой. После этого он обнаружил, что охлажденный продукт светится в темноте красноватым светом. Известие об этом произвело сенсацию среди алхимиков, и камень стал объектом алхимических и химических исследований. Он получил ряд названий — солнечный камень, болонский камень, болонский фосфор и др. Долгое время элемент считали видоизмененной формой гипса. В 1774 году Йохан Готлиб Ган и его друг Шееле Карл Вильгельм исследовали камень и установили, что в нем содержится особая «земля». Несколько позднее, в 1779 году, Гитон де Морво назвал эту землю барот, а в дальнейшем изменил название на барит. Под этими названиями бариевая земля описывалась в учебниках химии конца XVIII и начала XIX веков. Содержащийся в нем неизвестный металл стали называть барий от греческого слова тяжелый[10].
Классификация
Металлы по химическим свойствам делятся на группы[11]:
- Щелочные — элементы 1-й группы периодической таблицы химических элементов: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
- Щёлочноземельные — элементы 2-й группы периодической таблицы химических элементов: бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba, радий Ra.
- Переходные — элементы побочных подгрупп периодической системы химических элементов: скандий Sc, титан Ti, ванадий V, хром Cr, марганец Mn, железо Fe, кобальт Co, никель Ni, медь Cu, цинк Zn, иттрий Y, цирконий Zr, ниобий Nb, молибден Mo, технеций Tc, рутений Ru, родий Rh, палладий Pd, серебро Ag, кадмий Cd.
- Постпереходные — химические элементы, похожие по своим свойствам на металлы; располагаются справа от переходных металлов в периодической системе химических элементов: алюминий Al, галлий Ga, свинец Pb, олово Sn, таллий Tl, индий In, висмут Bi.
Металлы по физическим свойствам делят на группы[12]:
- Тяжёлые — например: мышьяк, свинец, кадмий, ртуть.
- Тугоплавкие — например: ванадий, вольфрам, гафний, молибден.
- Цветные — например: свинец, олово, цинк, никель.
- Благородные — золото, серебро и металлы платиновой группы.
Химические свойства
Металлам легче отдать электроны со своего внешнего энергетического слоя, именно поэтому в реакциях металлы — простые вещества будут выступать только в роли восстановителей[13]. В зависимости от активности, металлы подразделяют на три группы[14]:
- Активные металлы: Li, K, Ba, Sr, Ca, Na, Mg, Al. Эти металлы легко вступают в химические реакции и легко окисляются кислородом воздуха, поэтому их хранят в специальных жидкостях, например в керосине. Отличаются мягкостью, лёгкостью, невысокой температурой плавления. Распространены в природе в виде солей хлоридов, нитратов, сульфатов, карбонатов и тд. Реагируют с кислородом и водой без нагревания.
- Металлы средней активности: Mn, Zn, Cr, Cd, Ni, Pb. Распространены в природе в виде оксидов и сульфидов. С кислородом и водой реагируют при нагревании. Они взаимодействуют с кислотами с образованием водорода.
- Малоактивные металлы: Cu, Ag, Hg, Au, Pt. Распространены в природе в виде оксидов и сульфидов, а также в самородном виде. Не способны вытеснять водород из кислот.
Чем активнее металл, тем проще он будет отдавать электроны, а значит будет проявлять более сильные восстановительные свойства и первым взаимодействовать с окислителем[15].
Рассмотрим взаимодействия металлов с другими веществами[15]:
- С неметаллами: металлы в реакции с ними образуют бинарные соединения, в которых металл имеет положительную степень окисления, а неметалл- отрицательную.
- С водой: с жидкой водой взаимодействуют только активные металлы, образуя щелочи.
- С растворами кислот: металлы, находящиеся в ряду активности левее водорода, способны вытеснять его, образуя с кислотным остатком соль.
- С кислотами- окислителями: в пример можно привести реакцию с серной кислотой: в разбавленном виде она является окислителем за счёт протона. Продукты восстановления серной кислоты зависят от активности металла, с которым она реагирует.
- С солями: металлы вытесняют менее активный металл и образуют с кислотным остатком новую соль.
- С щелочами: амфотерные металлы (Be, Al, Zn и др) при взаимодействии с кислотами и с щелочами с образуют комплексы (при нагревании комплексы не образуются).
Физические свойства
Металлы обладают следующими общими свойствами[13].
- Характерный металлический блеск.
- Прочность: металлы обладают высокой устойчивостью к механическим нагрузкам и деформациям. Это качество делает их идеальным материалом для таких потребностей человека, как: строительство зданий, мостов, дорог и транспортных средств. Они также используются в производстве оружия, шариковых подшипников, инструментов и других предметов, которые должны выдерживать высокие нагрузки[16].
- Электропроводность: металлы имеют способность передавать электрический ток с незначительными потерями- именно по этой причине они используются электрических проводах и контактах, а также в производстве электроники и электротехники . Без металлов невозможно создание эффективных электрических систем и устройств[17].
- Теплопроводность: металлы могут эффективно и быстро передавать тепло. По этой причине металлы используются в отопительных системах, радиаторах, котлах и других устройствах для передачи тепла. Они также широко применяются в производстве кухонной посуды, в которой необходимо равномерное распределение тепла.
- Высокая степень устойчивости к коррозии: некоторые металлы, такие как алюминий и нержавеющая сталь, обладают естественной способностью к самозащите от окисления. Благодаря этому они могут использоваться в суровых условиях и при повышенной влажности, сохраняя свои свойства и прочность. Это делает их незаменимыми в строительстве кораблей, морской и нефтяной промышленности. Металлы также используются в производстве множества бытовых предметов. Металлические посуда, мебель, посудомоечные и стиральные машины, холодильники — все это неотъемлемая часть нашей повседневной жизни. Металлы обеспечивают прочность и долговечность этих предметов и делают их стабильными в использовании. Кроме того, металлы играют важную роль в медицине. Медицинские инструменты и имплантаты изготавливаются из металлов, таких как титан и нержавеющая сталь[18].
- Пластичность. Металлы способны менять форму при механическом воздействии — это следствие строения их кристаллической решетки[19].
Получение
- Нахождение металлов в природе. Большинство металлов встречаются в природе в виде различных химических соединений. Например: алюминий (вследствие высокой химической активности алюминий в природе существует только в виде соединений: он входит в состав силикатных пород — глины, слюды и полевого шпата), железо (железо встречается в природе в свободном виде, накапливается в осадочных породах и входит в состав разновидностей суглинка, глины, песка красного, бурого и жёлтого цвета), натрий (в свободном виде в природе не встречается, но может быть получен из различных соединений: он находится в составе многочисленных минералов, включая полевые шпаты, содалит и «каменную соль»).
- Получение активных металлов. Активные металлы (щелочные и щелочноземельные) можно получить, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
- Получение малоактивных и неактивных металлов. Такие металлы восстанавливают из оксидов углём, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
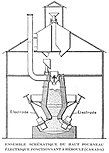
- Производство чугуна. Чугун получают из железной руды в доменных печах[20].
Применение
Металлы и их сплавы используются во многих сферах человеческой жизни, например:
- Никель и хром применяются для создания антикоррозионных покрытий.
- Ртуть используется для создания термометров.
- Платина и палладий — в качестве катализаторов.
- Золото и серебро используются для создания ювелирных украшений, а так же в технике.
- Свинец применяется в производстве аккумуляторов.
- Олово находится в составе сплавов, нужных для производства консервных банок, а также при пайке.
Добавление в сплавы редких металлов (бериллий, ванадий, вольфрам, галлий, германий, индий, литий, титан, молибден, редкоземельные элементы) улучшает их твёрдость, теплопроводость, электропроводность и прочность[21].
Примечания
- ↑ Металлы (неопр.). Foxford. Дата обращения: 16 июня 2024.
- ↑ Металлы. Foxford. Дата обращения: 1 июня 2024.
- ↑ Металлы. Foxford. Дата обращения: 1 июня 2024.
- ↑ Металлы. Foxford. Дата обращения: 1 июня 2024.
- ↑ Каганов Моисей Исаакович, Эдельман Валериан Самсонович, Зимина Галина Владимировна, Крапошин Валентин Сидорович. Г. В. Зимина (химические свойства и получение), В. С. Крапошин (механические свойства). Металлы. Большая российская энциклопедия (10 января 2023). Дата обращения: 1 июня 2024.
- ↑ 6,0 6,1 Зимина Галина Владимировна. Медь (неопр.). Большая российская энциклопедия (2 июня 2022). Дата обращения: 11 июня 2024.
- ↑ Кузьминых Сергей Владимирович, Попов Владимир Александрович. Железо (неопр.). Большая российская энциклопедия (5 июня 2023). Дата обращения: 11 июня 2024.
- ↑ Зимина Галина Владимировна. Литий (неопр.). Большая российская энциклопедия (1 августа 2022). Дата обращения: 16 июня 2024.
- ↑ Зимина Галина Владимировна. Калий (неопр.). Большая российская энциклопедия (3 октября 2022). Дата обращения: 16 июня 2024.
- ↑ Третьяков Юрий Дмитриевич, Зайцев Дмитрий Дмитриевич. Барий (неопр.). Большая российская энциклопедия (24 августа 2022). Дата обращения: 16 июня 2024.
- ↑ Особенности строения и свойств металлов (неопр.). Foxford. Дата обращения: 12 июня 2024.
- ↑ Особенности строения и свойств металлов (неопр.). Foxford. Дата обращения: 12 июня 2024.
- ↑ 13,0 13,1 last. Общие свойства металлов. (неопр.). Дата обращения: 11 июня 2024.
- ↑ Химические свойства металлов (неопр.). Skysmart (20 ноября 2021). Дата обращения: 10 июня 2024.
- ↑ 15,0 15,1 Химические свойства металлов (неопр.). Skysmart (20 ноября 2021). Дата обращения: 11 июня 2024.
- ↑ Общие физические свойства металлов (неопр.). Yaklass. Дата обращения: 16 июня 2024.
- ↑ Пудалов Владимир Моисеевич. Двумерные проводники. Большая российская энциклопедия (10 октября 2022). Дата обращения: 1 июня 2024.
- ↑ Особенности строения и свойств металлов (неопр.). Foxford. Дата обращения: 16 июня 2024.
- ↑ Типы кристаллических решеток (неопр.). Yaklass. Дата обращения: 16 июня 2024.
- ↑ Получение и применение метллов (неопр.). Fosford. Дата обращения: 11 июня 2024.
- ↑ Получение и применение метллов (неопр.). Foxford. Дата обращения: 11 июня 2024.