Олово
| |||||
| Свойства атома | |||||
|---|---|---|---|---|---|
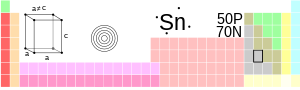
| Имя, символ, номер | Олово, 50 | ||||
| Группа, период, блок | 14, 5, p-элемент | ||||
| Атомная масса (молярная масса) |
118,7 а. е. м. (г/моль) | ||||
| Радиус атома | 162 пм | ||||
| Химические свойства | |||||
| Ковалентный радиус | 141 пм | ||||
| Радиус иона | (+4е)71(+2)93 пм | ||||
| Электроотрицательность | 1,96 (шкала Полинга) | ||||
| Электродный потенциал | -0,136 | ||||
| Степени окисления | +2,+4 | ||||
| Энергия ионизации (первый электрон) |
708,2 (7,34) кДж/моль (эВ) | ||||
| Термодинамические свойства простого вещества | |||||
| Плотность (при н. у.) | 7,31 г/см³ | ||||
| Температура плавления | 230,90°C | ||||
| Температура кипения | 2893 К, 2620°C | ||||
| Теплота плавления | 7,19 кДж/моль | ||||
| Теплота испарения | 296 кДж/моль | ||||
| Молярный объём | 16,3 см³/моль | ||||
| Кристаллическая решётка простого вещества | |||||
| Структура решётки | тетрагональная | ||||
| Параметры решётки | a=5,831; c= 3,181 Å | ||||
| Отношение c/a | 0,546 | ||||
| Температура Дебая | 170,00 K | ||||
| Прочие характеристики | |||||
| Теплопроводность | (300 K) (300) 66,8 Вт/(м·К) | ||||
| 50 | Олово
|
| 4d105s25p2 | |
О́лово (лат. «stannum» — «прочный, стойкий») — химический элемент IV группы короткой формы (14-й группы длинной формы) Периодической системы химических элементов Д. И. Менделеева с порядковым номером №50, атомной массой 118,710 а. е. м.. Химический символ — Sn. При нормальных условиях — это пластичный, ковкий и легкоплавкий блестящий постпереходный металл серебристо-белого цвета. Природное олово имеет 10 изотопов: 112Sn (0,97 %), 114Sn (0,66 %), 115Sn (0,34 %), 116Sn (14,54 %), 117Sn (7,68 %), 118Sn (24,22 %), 119Sn (8,58 %), 120Sn (32,59 %), 122Sn (4,63 %), 124Sn (5,79 %; слабо радиоактивен, β-излучатель, период полураспада Т1/2 более 1017 лет). Искусственно получены радиоизотопы с массовыми числами 100–137[1].
Историческая справка
Олово — один из металлов, который использовался людьми с древних времен. Оловянная посуда отлично сохраняла аромат и вкус напитков. Однако изделия из олова были редкими из-за высокой стоимости и ограниченной доступности этого металла.
До наших времен дошли предметы домашнего обихода из стран древнего мира: тарелки, сосуды для хранения масла и вина. Все эти артефакты были изготовлены в третьем тысячелетии до нашей эры из бронзы, которая является сплавом меди и олова. Историки считают, что олово известно более шести тысячелетий, начиная с IV века до нашей эры. До настоящего времени оловом называли сплав серебра и свинца. Древние люди часто ошибочно считали, что белое или блестящее олово — это разновидность черного свинца. История применения олова уходит корнями в Древнюю Грецию. Термин «касситерит» или оловяная руда (SnO2) греческого происхождения [2]. Он получил свое название из-за месторождения. Его добывали на Британских островах, которые назывались Касситеридами. Сам термин «олово» в переводе означает стойкий, прочный[1].
Строение
Атом олова состоит из положительно заряженного ядра с зарядом +50, 50 протонов и 69 нейтронов, на пяти орбиталям расположены 50 электронов — +50Sn)2)8)18)18)4. Полная электронная конфигурация атома олова — 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p2 [3].
Внешний энергетический уровень атома олова содержит 4 валентных электрона. свидетельствует о том, что для олова характерна степень окисления олова +2, что объясняется наличием двух неспаренных электронов на внешнем энергетическом уровне. В возбуждённом состоянии атом олова приобретает степень окисления +4 за счёт наличия вакантных орбиталей 5d-подуровня. В соответствии с конфигурацией внешних электронов атома 5s25р2 олово имеет две степени окисления: +2 и +4; последняя более устойчива[1].
Нахождение в природе
Олово присутствует в земной коре в количестве 8·10–3 % по массе, в чистом виде не обнаружено, а сконцентрировано в около 20 минералах. Наибольшее промышленное значение имеет касситерит (SnO2), также известный как оловянный камень, в то время как станнин (Cu2FeSnS4), или оловянный колчедан, имеет меньшее значение. Олово обычно образуется в результате магматических и гидротермальных процессов, причем касситерит может быть найден как в гранитах, так и в россыпях. Содержание олова в биосфере невелико, и его присутствие в морской воде составляет всего лишь 3·10–7 %. Некоторые водные растения, однако, могут содержать повышенное количество олова.[1].
Физические свойства
Олово — мягкий легкоплавкий металл, имеющий температуру плавления 230,9 °C, а температура кипения 2620 °C, обладающий уникальными свойствами. Если быстро согнуть палочку из олова, можно услышать характерный треск — это звук трения кристаллов олова друг о друга. При температуре ниже 13,2 °С более стабильной является форма олова — серое олово. Самопроизвольный переход белого олова в серое сопровождается сильным увеличением объёма (на 25,6%), приводя к рассыпанию металла в порошок. Этот процесс ускоряется с понижением температуры и достигает максимума при -33 °С. Такой переход резко ускоряется в присутствии даже небольшого количества серого олова, которое «заражает» белое олово. Этот процесс получил назвали «оловянной чумой» и стал главной причиной гибели участника экспедиции Роберта Скотта к Южному полюсу в 1912 году, так как жестяные ёмкости с топливом были паяны оловом и при морозе они начали протекать. Олово устойчиво к коррозии, не токсично, поэтому оловом покрывают жесть консервных банок («луженая жесть»). Сплав 1/3 свинца и 2/3 олова («третник») плавится при 182 °C, что на 50 °С ниже, чем чистое олово и на 145 °С ниже, чем свинец. Сплав используют для пайки металлов[4].
Химические свойства
Соединения олова Sn (II) — являются сильными восстановителями. При температуре до 100 °С олово практически не подвержено окислению как сухом, так и на влажным воздухе, благодаря тонкой, прочной и плотной пленке SnO2, которая его защищает. Олово также устойчиво к воздействию холодной и кипящей воды. Стандартный электродный потенциал олова в кислой среде составляет -0,136 В[5].
При комнатной температуре олово также не подвержено воздействию воздуха или воды благодаря образованию поверхностной оксидной пленки. Окисление заметно начинается только при температурах выше 150 °C:
Sn + O2 = SnO2.
При воздействии разбавленных кислот, таких как соляная (HCl) и серная (H2SO4), на олово при низкой температуре происходит медленное вытеснение водорода. В результате образуются хлорид олова (SnCl2) и сульфат олова (SnSO4):
SnSO4 + 2 HCl = H2SO4 + SnCl2
При нагревании олово растворяется в горячей концентрированной серной кислоте (H2SO4), образуя соединение Sn(SO4)2 и газообразного диоксида серы (SO2):
SnO + 3 H2SO4 = Sn(SO4)2 + SO2 + 3 H2O
Холодная (0°С) разбавленная азотная кислота действует на олово по реакции:
4Sn + 10HNO3 = 4Sn(NO3)2 + NH4NO3 + 3H2O.
При нагревании олова с концентрированной азотной кислотой HNO3 (плотность 1,2-1,42 г/мл) происходит окисление олова, в результате чего образуется осадок метаоловянной кислоты H2SnO3. Степень гидратации этой кислоты может изменяться[5].
3Sn + 4HNO3 + nH2O = 3H2SnO3·nH2O + 4NO.
При нагревании олова в концентрированных растворах щелочей выделяется водород и образуется гексагидростаниат K2[Sn(OH)6] :
Sn + 2KOH + 4H2O = K2[Sn(OH)6] + 2H2.
Кислород воздуха взаимодействует с оловом, образуя на его поверхности плёнку SnO2. Оксид (IV) SnO2 является очень стойким, в то время как его оксид (II) SnO быстро окисляется. Оксид олова (IV) SnO2 обладает преимущественно кислотными свойствами, в то время как SnO проявляет основные[5].
Олово не реагирует с водородом, гидрид олова SnH4 образуется при взаимодействии Mg2Sn с соляной кислотой:
Mg2Sn + 4HCl = 2MgCl2 + SnH4.
Гидрид SnH4 — то бесцветный ядовитый газ с температурой кипения -52 °С. Он очень нестабилен и при комнатной температуре разлагается на олово и водород в течение нескольких суток, а при температуре выше 150°С — мгновенно. Также образуется при действии водорода на соли олова:
SnCl2 + 4HCl + 3Mg = 3MgCl2 + SnH4[5].
Получение
Промышленное производство олова оправдано при его содержании в россыпях на уровне 0,01 % по массе и в рудах на уровне 0,1 %. Для обогащения первичного сырья применяются различные методы: для россыпей основным способом является гравитационный метод, а для руд — флотационный или флотогравитационный. Полученные концентраты, содержащие 50–70 % олова, подвергаются обжигу для удаления серы, а затем проходят очистку от железа с использованием соляной кислоты HCl. В случае обнаружения примесей вольфрамита WO4 и шеелита CaWO4, концентрат обрабатывается HCl; образовавшийся WO3·H2O извлекается с помощью раствора аммиака. Путем плавки концентратов с углём в электрических или пламенных печах получают черновое олово (94–98% Sn), содержащее примеси меди Cu, свинца Pb, железа Fe, мышьяка As, сурьмы Sb, висмута B[6]i.
В процессе производства чернового олова из печей происходит фильтрация при температуре 500–600 °C с использованием кокса или центрифугирования для удаления основной массы примесей железа. Для устранения остаточного железа и меди из жидкого металла добавляется сера, что приводит к образованию твердых сульфидов, которые затем удаляются с поверхности олова. Для очистки олова от примесей мышьяка и сурьмы используется добавление алюминия, а от свинца применяется хлорид свинца SnCl2. Примеси висмута и свинца удаляются путем вакуумирования. Для получения высокочистого олова применяется электролитическое рафинирование и зонная перекристаллизация[6].
Большая часть производимого олова представлена вторичным металлом, который извлекается из отходов белой жести, лома и различных сплавов. По данным за 2019 год, доля рециркуляции олова составляет более 20%. Глобальный объем производства олова в 2019 году составил 329 тыс. тонн[1].
Применение
Олово — компонент сплавов: с медью (бронзы), медью и цинком (латунь), сурьмой (баббит), свинцом (припой), цирконием, титаном, ниобием (атомные реакторы, турбины, сверхпроводники) и др. Олово также находит применение[1]:
- в нанесении покрытий на металлы,
- изготовлении фольги, деталей измерительных приборов, теплообменников, художественных изделий и др.
Оксид олова SnO2 используется для изготовления жаростойких эмалей и глазурей, а соли олова (II) применяются для протравного крашении тканей. Некоторые соединения олова, такие как кристаллический сульфид олова SnS2 («сусальное золото») используются в составе красок для имитации позолоты, а фторид олова SnF2 —добавляется во фторсодержащие зубные пасты[1].
Примечания
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Аликберова Людмила Юрьевна. Олово. Большая Российская энциклопедия (8 июня 2023). Дата обращения: 22 мая 2024.
- ↑ История открытия олова. Дата обращения: 20 мая 2024.
- ↑ Строение атом олова. SolverBook. Дата обращения: 28 мая 2024.
- ↑ Леенсон И.А. Химические элементы. Популярный иллюстрированный гид. — Москва: АСТ, 2021. — С. 135-136.
- ↑ 5,0 5,1 5,2 5,3 Олово. Химические свойства. Металлы и металлургия. Дата обращения: 22 мая 2024.
- ↑ 6,0 6,1 Производство цветных меаллов. Производство олова. Metal.Spase. Дата обращения: 30 мая 2024.
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |